
摘要
为了提高体外皮肤组织模型的物理相关性和可翻译性,增强其结构复杂性是非常重要的。通过使用3D生物打印技术和合适的生物墨水,可以调节真皮和表皮的结构并将细胞和材料精确地沉积在所需的位置。在本研究中,使用BIO X生物打印全厚度皮肤组织模型。真皮使用原代真皮成纤维细胞嵌入GelXA skin bioink进行生物打印,表皮含有高浓度角质形成细胞嵌入ColMA,沉积在真皮顶部。皮肤模型总共培养了14天,在开始气液界面培养的第6天和培养的第14天结束时收集了样品。第1类人胶原蛋白(角蛋白14)的免疫荧光染色,角蛋白10和丝蛋白表明,所有标记物的表达均随时间增加。真皮中的胶原蛋白网络得到加强,并且表皮中的角质形成细胞明显地自我重组:随着大量的丝聚蛋白向表皮的外层移动,在角质形成细胞中角质蛋白10急剧增加。这些结果表明,强健的皮肤组织模型可以通过3D生物打印来创建,从而验证了该技术在该领域的适用性。
引言
皮肤是我们与外部环境的第一个也是主要的界面,是极具吸引力的再生器官,并且在过去40年中科学家们对其进行了大量探索(Loai,2019; Tarassoli,2017)。 部分原因是皮肤组织模型的广泛应用领域,从药物筛选到化妆品测试以及伤口愈合研究,部分原因是皮肤组织的组成相对简单,可以分为两层,每层具有一类主要的细胞类型 这种简单构成意味着过去已经建立几个2D模型和培养系统。 但是,这些模型无法完全概括天然皮肤,并且缺乏3D模型提供的空间组织(Loai,2019; Singh,2020; Vijayavenkataraman,2016)。 为了增加物理相关性并增强体外结果与体内条件的可翻译性,迫切需要以3D方式调制皮肤组织模型。
在开发用于构建3D皮肤模型的不同技术中,生物打印制造方法在克服与组织建模有关的挑战方面已显示出广阔的前景(Pati,2016; Singh,2020),由于使研究人员能够精确地模拟所需的结构,并根据需要自由地结合不同的细胞和材料。 关键是要使用合适的基质配方,以便打印出稳定的三维结构,支持细胞增殖和迁移,同时确保结构的稳定性和机械完整性 (Tarassoli, 2017; Vijayavenkataraman, 2016)。
在3D生物打印中,天然和合成生物材料相结合形成可打印的生物墨水。 天然生物材料的好处是可以减轻环境对细的影响,而合成生物材料具有更好的机械性能(Murphy,2014年)。 3D生物打印中使用的两种最常见的天然生物材料是明胶和胶原蛋白。 胶原蛋白是人体中最丰富的蛋白质,是细胞外基质(ECM)的关键角色,可促进出色的细胞通讯(Kular,2014年)。 但是,纯胶原蛋白很难处理,因为必须将其保持在4°C或酸性以避免固化。
明胶,源自胶原蛋白,所以保留了胶原蛋白的一些细胞特征,但具有在室温下为固体而在体温下为液体的化学优势。甲基丙烯酸明胶(GelMA)是一种可印刷的生物墨水,可在27°C下使用光进行交联,从而诱导甲基丙烯酸酯基团之间形成共价键。 与甲基丙烯酸酯基团的交联性的相同特征也可以添加到胶原蛋白中。 但是,甲基丙烯酸胶原蛋白(ColMA)仍需要在4°C下处理以避免固化。 这项研究中使用的GelXA生物墨水是由CELLINK开发的基于GelMA的生物墨水配方,旨在扩大GelMA的可印刷性范围,并易于形成复杂的3D结构。要了解有关不同生物材料和生物墨水特性的更多信息,请查看我们的生物墨水选择指南手册或访问我们的网页。
在这项研究中,我们旨在使用BIO X生物打印机打印出具有真皮和表皮的全厚度皮肤组织模型,GelXA SKIN生物墨水用于真皮,ColMA生物墨水用于表皮。在GelXA皮肤上,真皮的3D结构被牢固地生物打印出来 ,而ColMA的固有特性可以形成薄而丰富的表皮层。 在真皮中,重点是评估ECM的产生,特别关注1型胶原的产生,因为它是天然真皮的主要蛋白质。
对于表皮,选择了三种分化标记:用于增殖性角质形成细胞的角蛋白14(K14),用于区分角质形成细胞的角蛋白10(K10)和作为凝集层标记的丝聚蛋白。 天然皮肤的表皮具有明确的分化过程,其中附着在真皮上的增生角质形成细胞在皮肤最外层变成角质细胞(角质化角化细胞)(Eckhart,2013)。 在此角质化过程的不同层中,表达了特异性分化标记(图1)。 为了评估表皮的发育,我们选择评估指示标记的表达。

图1.天然表皮的成角过程(Eckhart,2013年)。
材料和方法
细胞准备
皮肤组织模型中使用了两种细胞:少年正常人皮肤成纤维细胞(NHDF,C-12300,PromoCell)和少年正常人皮肤表皮角质形成细胞(NHEK,C-12001,PromoCell)。 按照PromoCell的扩增方案(NHDF,NHEK)对细胞进行2D扩增后再进行生物打印,并分别用于第6-7代(NHDF)和第3代(NHEK)。 NHDFs在添加有生长培养基SupplementMix(C-39315,PromoCell)的成纤维细胞生长培养基(C-23010,PromoCell)中培养,而NHEK在PromoCell的角质形成细胞生长培养基的发育配方中与培养基SupplementMix(C-97294, PromoCell); 两种培养基均添加了1%的抗生素-抗真菌药(Gibco,100x)。
皮肤组织模型的生物打印
皮肤组织模型被设计为真皮篮,其实心底层上覆有两个网格层和6层高帽檐(图2)。 这是为了促进种子后表皮的包裹。 用GelXA SKIN(CELLINK,Ref#IK3X21110301)对皮肤篮子进行生物打印。 简而言之,收集了5.7 x 106 NHDF,旋转并重组为250 µL细胞悬液,然后将其小心地混入2.5 mL GelXA SKIN中,预热至37°C,然后转移到琥珀色滤芯中(CELLINK,参考编号CSO010311502)。为了除去残留的气泡,将带有嵌入式NHDF的GelXA SKIN滤芯在460G下离心1分钟。 然后,在开始打印会话之前,将墨盒安装在温度控制的打印头(CELLINK,参考号#00000020346)上,然后在准备好的BIO X生物打印机中温度设置成24°C,持续10分钟。
进行该步骤需要将GelXA生物墨水的温度平衡到24°C,这是适用于复杂结构的GelXA生物墨水的合适生物印刷温度。
然后真皮篮在24°C下用温控打印头以4至5 mm / s的速度,20至40 kPa的压力在12孔板中对进行生物打印,并将BIO X的打印床设置为 14℃。 然后先用405 nm光固化模块在高于构造物5厘米处用405 nm光固化模块将12个重复的真皮篮光固化15秒(每个构造物),然后浸入交联剂(CELLINK,参考号CL1010006001)中,并补充10 U / mL凝血酶5分钟。 然后将皮篮用成纤维细胞生长培养基洗涤一次,并在添加表皮之前与成纤维细胞生长培养基孵育(37°C,5%CO2)1小时。
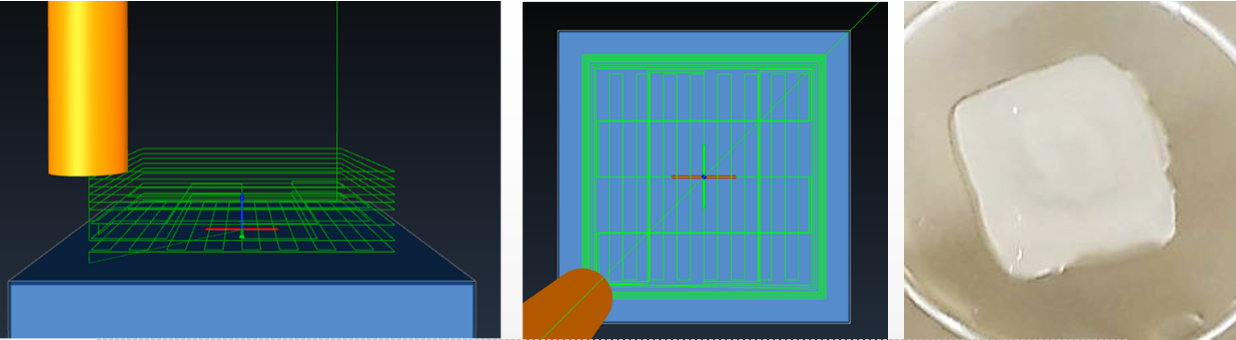
图2.培养14天后的3D生物打印模型的示意图,侧视图(左)和顶视图(中)以及生物打印的皮肤组织模型的图像(右)。
表皮的添加
对于表皮,使用ColMA(CELLINK,参考号IK4501022001)和NHEK的混合物。简而言之,将12 x 106 NHEK(每个皮肤篮1 x 106)重构为240 µL细胞悬液,并与240 µL ColMA(8 mg / mL,终浓度4 mg / mL)混合。将重构的ColMA置于冰上,直到将其添加到真皮结构中。从真皮篮中取出成纤维细胞培养基,并在每种真皮构建体的顶部添加40 µL表皮生物墨水-细胞混合物。在光固化30秒(405nm,距构建体5cm的距离)之前,将构建体在台式上放置15分钟以沉降。然后将样品以10G离心10秒,再光固化30秒。这是为了增强表皮和真皮之间的接触。然后将皮肤组织模型浸没在角质形成细胞生长培养基中,并在37°C,5%CO2下孵育6天,然后转移至气液界面培养物中。通过将构建体转移到补充有合适体积的角质形成细胞生长培养基的transwell插入物中来建立气液界面(图3)。每2至3天更新一次培养基。
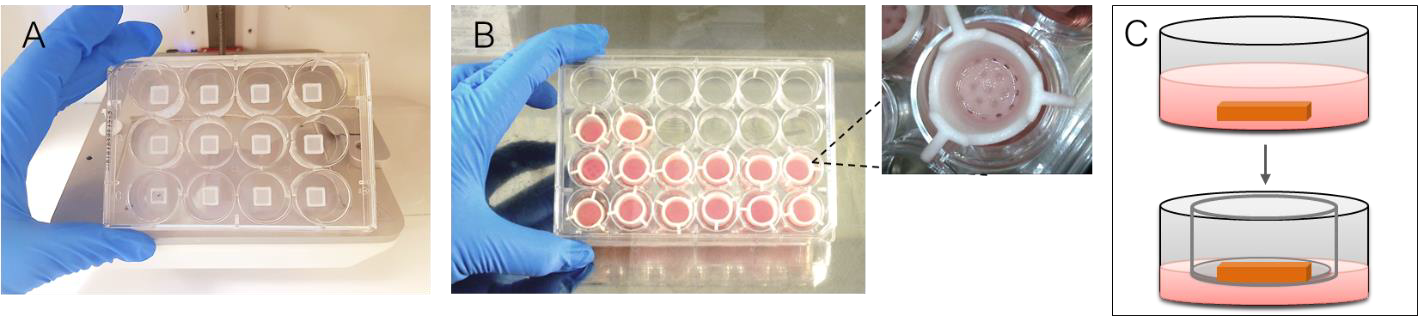
图3. A)生物打印的真皮篮子。 B)3D生物打印的皮肤组织模型转移到Transwell插入物中。 C)从皮肤组织模型的浸没培养到气液界面培养的转移的图示。
分析
根据CELLINK的固定方案,在第6天(开始气液界面)和第14天(实验结束)收集样品,并在4%PFA中固定以进行组织学染色。 然后将样品包埋在石蜡中,并按照CELLINK的方案进行切片。 他们对人类1型胶原蛋白(Atlas抗体,Ref#HPA011795,未报道发现可检测大鼠来源的ColMA),角蛋白10(Atlas抗体,Ref#HPA012014),角蛋白14(Abcam,Ref#ab7800)和丝蛋白(Atlas)染色 抗体,参考编号HPA030188),遵循CELLINK的免疫荧光染色方案,并使用Alexa Fluor 488(ThermoFisher,参考编号A-27034用于兔子,参考编号A-11029用于小鼠)作为第二抗体。 样品还按照CELLINK的H&E染色方案进行了H&E染色。 所有协议都可以在CELLINK的支持标签下的网页上找到。
结果与讨论
用于该皮肤组织模型的制造方法创建了完整且坚固的构造,该构造在整个实验过程中保持其形状。 样品横截面的H&E染色最初显示,两个隔层(真皮和表皮)之间的连接较弱。 但是在第14天,这两层已经合并(图4)。 在第14天,可以看到表皮平滑地沿着真皮的轮廓移动,并且角质形成细胞开始重组。

图4.在第6天和第14天分别以4倍和10倍放大率对皮肤组织模型进行H&E染色。 表皮在第6天图像中位于右侧,在第14天图像中位于右上方。 比例尺200 µm(放大4倍)和100 µm(放大10倍)。
H&E图像中真皮的强烈染色使得很难将成纤维细胞从生物墨水基质中分离出来,但是从免疫荧光(IF)染色中,可以观察到清晰的胶原网络形成(图5)。 胶原蛋白的表达已经在第6天出现,但是一直延续到第14天。成纤维细胞的数量在第14天也有所增加,表明真皮内成纤维细胞的增殖。 还对样品进行了弹性蛋白染色,但是没有弹性蛋白表达的迹象,表明该实验中的条件有利于表皮的形成。 如果在较长的培养时间内成熟,则可以在模型中检测到弹性蛋白。
仔细观察表皮的发育,免疫荧光图像显示整个培养过程中都保持了角蛋白14的表达,而在第14天角蛋白10和丝聚蛋白的表达均增加。 在表皮的中部,而角蛋白层(角质层的标记)应在表皮的最外层。 角蛋白10和丝蛋白的表达明显增加表明角质形成细胞已经开始分化。 在第14天,丝聚蛋白表达重新定位到构建体的顶部,朝向气-液界面,显示了细胞在生物打印模型内重组的能力。
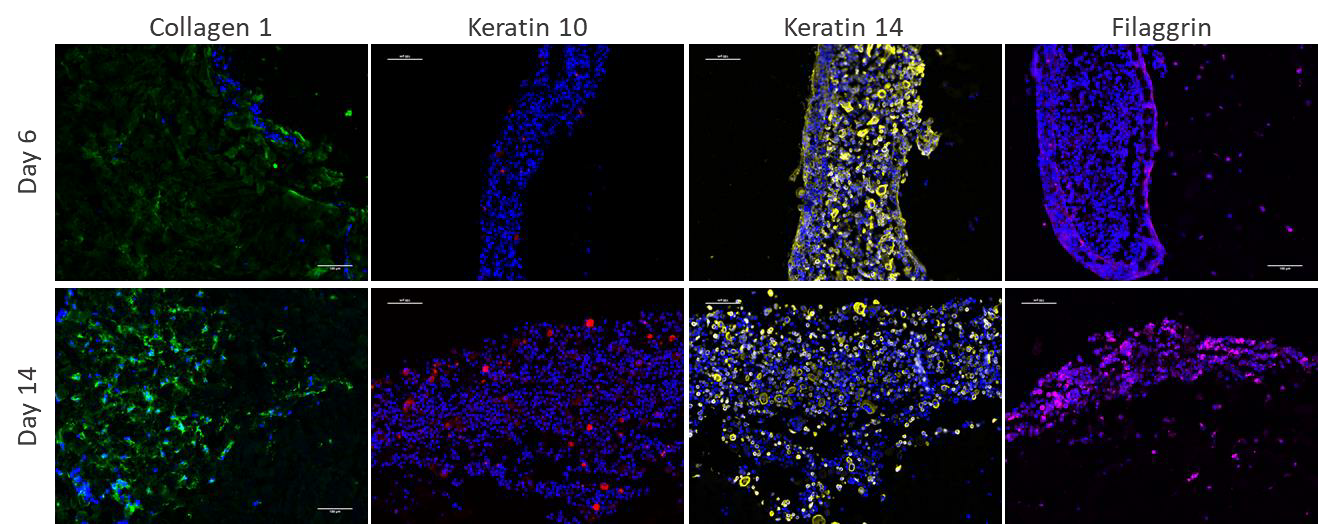
图5.在第6天和第14天用DAPI(蓝色)复染的1型胶原蛋白(绿色),角蛋白10(红色),角蛋白14(黄色)和丝蛋白(紫色)的免疫荧光图像。 角蛋白10、14和丝蛋白图像中图像的左边缘或上边缘。 放大倍数= 10倍。 比例尺= 100 µm。 在一个会话中采集图像以保持相同的采集参数。
在14天的培养期内,将构建体在最初的6天中浸入水下培养,然后转移至气液界面培养8天。 生物打印的皮肤组织模型显示真皮和重组表皮中胶原蛋白的产生增加,传统的分层分化模式开始形成。 稳定的角蛋白14表达(表明存在增殖的角质形成细胞)表明,有可能扩展模型的气液界面培养,以进一步成熟生物打印的皮肤构造。
结论
这项研究举例说明了如何使用原代细胞培养系统和CELLINK的3D生物打印平台对全厚度的皮肤组织模型进行3D生物打印。
➢ PromoCell的细胞和培养基细胞培养系统可以创建全厚度皮肤组织模型。 在当前模型中,细胞重组并增殖以形成更天然的细胞结构。
➢ GelXA SKIN生物墨水为皮肤发育提供了良好的环境,基于ColMA的表皮生物墨水支持皮肤组织模型内的表皮形成。
➢ 模型设计为表皮和真皮发育形成了一个强大的平台,在14天的培养期内保持稳定,但可以培养更长的时间,以使其他真皮和表皮标记物进一步成熟。
References参考文献
DOI:10.1177/2041731414557112.
DOI:10.1038/nbt.2958.

