
摘要
随着3D生物打印和人类诱导多能干细胞(hiPSCs)的出现,组织工程领域发展迅速,但由于缺乏功能丰富的厚组织,影响有限。绕过这一限制的方法之一是用含有 hiPSCs 的3D 生物打印组织。通过这种方式,iPSCs可以在实质细胞分化之前增殖并填充厚组织块。在这里 , 我们设计了一个灌注生物反应器,用于装载hipsc的3d生物打印室, 目的是在分化之前在 整个结构中增殖hipsc,以产生厚组织模型。生物反应器由数字光投影制成,经过优化,可 以在水凝胶室内部灌注而不会泄漏,也可以在外部提供流体流动,从而最大限度地提高整 个室壁的营养输送。经过7天的培养,我们发现在3ml min-1下间歇灌注(每15分钟15秒),相 对于在静态条件下培养的类似腔室,工程组织中的干细胞集落密度增加了1.9倍。我们还观 察到,相对于静态对照,灌注结构的组织壁内的菌落分布更均匀,反映了培养基中营养物 质的均匀分布。在流体流动的作用下,hiPSCs保持多能性和增殖性,产生平均约1.0 dyncm-2 的壁剪切应力。总的来说,这些充满希望的结果在灌注干细胞水凝胶后支持多种组织类 型的产生,并改善了厚度,因此增加了功能和实用性。
三维(3D)生物打印技术为创建人体疾病模 型提供了巨大的潜力,可以在体外对疾病机制、 进展和治疗进行器官级研究。生物打印还可以生 成功能性替代组织,用于治疗各种疾病。然而, 人体每个器官都有数十亿个细胞,要获得足够数量的细胞来创建具有代表性的体外组织并非易事 。虽然挤压生物打印的细胞密度通常高于其他打 印方式,但目前通常只能达到每毫升生物墨水数 千万个细胞的规模[1]。目前正在开发使用球体 或胚状体进行无支架生物打印的方法[2-4],从而提高打印组织的细胞密度。然而,除了自身的一系列局限性(包括球形变异性、可打印性和打印分辨率方面的挑战)外,这些方法仍然需要细胞放大和大容量培养基才能达到生理密度。为了解决工程组织中细胞密度低的问题,人们引入了原位干细胞扩增和分化的生物打印方法[5-11]。在这种方法中,被打印在生物墨水中的是干细胞而不是实质细胞。干细胞在分化成所需细胞类型之前,可在工程组织中扩增。这对涉及增殖或迁移能力有限的细胞类型(如心肌细胞)的应用尤其有益,也可作为使用源自患者的原始细胞的替代方法[5, 12, 13]。这种方法的另一个优点是,在分化过程中形成的关键细胞-细胞、细胞-细胞外基质(ECM)和 ECM-ECM 连接可以保持不变,不会被破坏。这一点非常重要,因为 ECM 组织对工程心脏组织的功能至关重要[14]。此外,在原位分化过程中形成并保存在三维生物打印结构中的微环境可实现人腔肌泵(hChaMP)的组织和心脏功能[5]。使用人类诱导多能干细胞(hiPSCs)打印的hChaMP 是由一种生物墨水生成的,这种墨水含有专门针对 hiPSC 生长和分化为心肌细胞而优化的 ECM。hiPSCs 在心肌细胞分化前增殖两周,从而使结构中的细胞密度更符合生理要求。因此,hChaMP 在整个结构中显示出连续的肌肉功能,这一点可以通过光学绘图和肌肉组织每次收缩时泵送液体的能力来证明。然而,虽然使用干细胞进行生物打印以及随后的扩增和分化是一项很有前景的技术,但由于营养供应不足,hChaMP显示出有限的组织厚度[5],这是组织工程领域众所周知的问题。营养物质(尤其是氧气)的供应限制了工程组织的厚度,通常只能达到 100-200 微米的存活组织[15]。然而,有了流体流动,就可以通过对流扩大营养物质的获取,从而开发出许多用于工程组织的生物反应器[16, 17]。由于多能干细胞对微环境敏感,而剪切应力已被证明可诱导小鼠干细胞造血[18],并促进干细胞衍生前体形成内皮细胞[19, 20],因此在工程组织中对流扩增hiPSC可能会诱发无意分化。相反,许多生物反应器研究表明,利用流体力学扩增干细胞聚集体或微载体,其效力损失有限[21-25]。在此,我们介绍了为hChaMP开发的灌注生物反应器。我们的研究表明,间歇灌注hChaMP可使细胞密度在培养一周后增加近两倍。
此外,尽管暴露在剪切应力下,hiPSCs仍能保持多能性,而剪切应力近似低于其他常见的干细胞扩增生物反应器。这些结果表明,扩增的iPSCs分化成所需细胞类型后,有望生成厚组织模型。
2.1. hChaMP制造
通过Autodesk Meshmixer和Blender(图1(a)),根据之前报道的结构[5]重新设计了hChaMPs ,并在Slic3r中生成了g代码。打印前一天,在含有 75% mTeSR1(STEMCELLTechnologies,cat#85850)、25% 醋酸(20 mM)和1.3% 苯基-2,4,6-三甲基苯甲酰膦酸锂(LAP,Allevi)的溶液中,将甲基丙烯酰明胶(GelMA;明尼苏达大学生物打印设备)在60℃下重组至 26.7% w/v。甲基丙烯酸胶原(ColMA;Advanced Biomatrix,cat#5198)在 20 µM乙酸中溶解至2% w/v,温度为37℃。打印前,混合GelMA和ColMA溶液(3:1 GelMA溶液:ColMA溶液,即 20% w/v GelMA,0.5% w/v ColMA),并用1M 氢氧化钠中和。这些研究中使用了 hiPSCs(在肌球蛋白重链基因[26]下过表达细胞周期蛋白 D2,雌性)。hiPSCs 在 基底膜基质(Corning,cat#08-774-552)上的 mTeSR1 中保存,并通过 ReLeSR(STEMCELL Technologies,cat#05872)定期传代。打印时,用细胞消化液(Millipore Sigma,cat#A6964)将汇合度为 60%-80% 的 hiPSCs单个化。细胞悬浮液清洗后离心两次,以除去可能降解基质支架的多余细胞消化液。然后将细胞以 3000 万个细胞 ml-1 的量重悬在 ECM 溶液中,该溶液含有 187 µg ml-1 小鼠层粘连蛋白/肠粘连蛋白(LN;Corning,cat#354259)、187µg ml-1 人纤连蛋白(FN;Corning,cat#356008 或 R&D systems,cat#1918-FN-02M)和10 µM Y-27632 ROCK 抑制剂(Selleckchem,cat#S1049)的 mTeSR1,并在室温下孵育 15 分钟。hChaMPs 在INKREDIBLE挤压式生物打印机(CELLINK)上打印。为了提高低粘度生物墨水的分辨率,打印是在基于 FRESH v2.0[27]的支撑浴中进行的。支撑浴是在生物安全柜中制作的,以保持无菌状态;52.5%的无菌Milli-Q水和47.5%的乙醇混合物在辅助容器中制作的水浴中加热到45℃。以每分钟400转的速度搅拌混合物,并用铝箔覆盖以减少蒸发。加入氢氧化钠(1mM)使pH值升至7,然后加入B型明胶(SigmaAldrich,cat#G9382,2% w/v)和阿拉伯树胶(Sigma Aldrich,cat#9752,1% w/v)。溶液在45℃下混合10分钟,然后冷却至35℃,然后缓慢冷却至25℃(<1℃ min-1)。然后降低温度至10℃,再搅拌5分钟。将混合物转移到锥形管中,在100G下离心4分钟。将上清替换为冷的、无菌的Milli-Q水,管子旋转,在500G下离心5分钟。然后用冷的、无菌的1X磷酸盐缓冲盐水(PBS;Fisher Scientific, cat#BP3994),并保存在4℃,直到打印当天。此时,在1200G下离心3分钟,去除多余的PBS,薄层紫外线照射30分钟。生物墨水在27°C下用27 G, 1英寸针头打印。如前所述[5],为了保持打印结构的一致性(这对灌注设置很重要),压力根据针头的墨水滴速而变化。对于给定的打印结构,这里使用的墨水,滴针之间的滴速为3.1秒。在六个面各打印20秒后,墨水与蓝光(405 nm)交联。然后将支撑液中的打印物移到培养箱中熔化支撑液,然后用温暖、无菌的Dulbecco PBS (DPBS;不含Ca2+和Mg2+;Thermo Fisher Scientific,编号14190144)。hChaMPs在5µM Y-27632的mTeSR1中培养过夜,在静态条件下允许细胞附着。
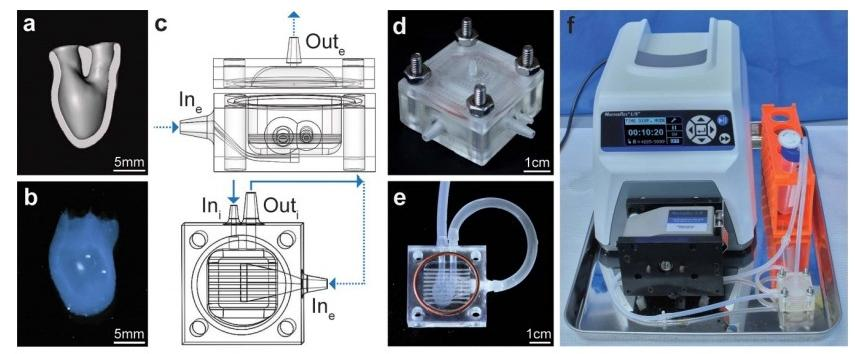
图1所示。hChaMP和生物反应器设计。(a)hChaMP模型横切面(正面)为灌注腔内。(b)生物3d打印的hChaMP。(c)生物 反应器模型,生物反应器的侧视图,包括顶部和底部部分(上)和底部部分的自顶向下视图(下),底部部分为hChaMP。
该设计允许灌注hChaMP 内部(实箭头),以及围绕hChaMP 外部的流体流动(虚线箭头)。hChaMP 轻轻放置在细水平杆上 ,允许在hChaMP底部周围进行外部灌注。(d)3d 打印生物反应器,由螺母、螺栓和硅胶垫圈组装而成。(e)生物反应器 中的hChaMP。油管将hChaMP连接到生物反应器。(f)整个灌注装置,生物反应器连接到泵和介质储存器。
2.2. hChaMP 灌注
在SOLIDWORKS中设计生物反应器,其中hChaMP内部灌注端口(Ini和Outi)和hChaMP外部流动端口(Ine和Oute)(图1(c))。生物反应器通过Perfactory IV数字光投影打印机(EnvisionTEC)使用E-shell 300 (EnvisionTEC,cat#1500300)进行3d打印(图1(d))。灌注时,使用Masterflex L/S标准数字驱动器(cat#07522-30)与Masterflex L/S 14铂固化硅胶管(1.6 mm ID, cat#96410-14)。培养基储液器是一个50 ml的锥形管,盖子上有三个孔,两个用于流体的进出口,一个用于0.22µm注射器过滤器(Whatman, cat#6780-2502),允许在培养基中进行无菌氧气交换。培养基储层最初填充两倍体积的培养基(mTeSR Plus [STEMCELLTechnologies, cat#100-0276]),并添加100 μml – 1青霉素,100 μ ml – 1链霉素[penp -strep;Thermo Fisher Scientific, cat#15140122]用于灌注的第一天),而不是管道和生物反应器中所需的系统。这样,在随后的日子里,只需简单地更换锥形管,就可以更换 50%的培养基(mTeSR Plus,no pen-strep),从而最大限度地减少排空管道时可能发生的污染和气泡形成。静态对照在具有等量培养基的立式T25烧瓶中培养,每天也更换50%的培养基。
打印1天后开始灌注。生物反应器在生物安全柜中紫外线照射下,70%乙醇浸泡30分钟灭菌。然后用无菌的1X PBS洗涤生物反应器三次。为了准备hChaMP进行灌注(图S1),将hChaMP移至有温DPBS的培养皿中。硅胶管(15mm长,2mm内径,3mm外径;将uxcell (cat#a19011600ux0295)插入hChaMP的两条血管中。将插入管的hChaMP移至干净、干燥的培养皿中,在管和hChaMP的界面处移液无菌的20% GelMA(含0.5% w/v LAP,如上所述溶解于mTeSR1和乙酸中),同时用蓝光交联。将hChaMP移动到充满DPBS的生物反应器中,使用无菌细齿钳将管的另一端插入生物反应器通道中(图1(e))。20%的GelMA被添加到每根油管的两端,以形成防止泄漏的密封。Outi的管(Masterflex C-Flex管,3.2 mm ID,编号06422-04)充满DPBS,并连接到生物反应器上,以消除Outi的表面张力,这种张力会产生压差,阻碍hChaMP的灌注。为了检查内部灌注是否有泄漏,用食用色素染色的DPBS(通过0.22µm过滤器过滤)用注射器和针头注射到Ini。如果油管连接处存在泄漏,则使用20%以上的GelMA。染色的DPBS用mTeSR Plus温水冲洗。然后将生物反应器连接到灌注装置上。将生物反应器连接到引管上,在生物反应器上放置30mm硅胶垫片,并用螺母和螺栓固定生物反应器盖。将泵打开至3ml min – 1,以去除生物反应器中剩余的空气。将灌注设置(图1(f))移至培养箱(37℃,5% CO2),并将流量改为间歇,每15分钟以3ml min – 1的速度流动15 s。每天进行50%的介质更换,直到灌注结束。
2.3. 计算模拟
为了建立 hChaMP 中流体流动的计算模型,在生物反应器的入口和出口处测量了流动下的压力。简言之,如上所述,将无细胞 hChaMP 插入生物反应器并连接流动。在生物反应器入口或出口的底部放置止血阀(Qosina,cat#80395),以便在设置中插入压力导管。使用 ADV500 PV系统和 1.4 Fr 压力导管(Transonic)测量压力曲线,数据采集采样率为 5000 Hz。在Simvascular中使用流固相互作用(FSI)方法来解析内部流动[28]。根据实验结果,采用弹性模量为1.96 kPa的新hookean模型来描述墙。流体模型采用牛顿流体模型,粘度为1 cP,用波形描述进口的间歇流动,并在出口施加与实验结果相匹配的压力作为边界条件。为了稳定系统中的压力,在明尼苏达超级计算研究所进行了十个周期的模拟。外部流动使用Ansys Fluent, release 20.1进行求解,假设墙壁是刚性的。与内部流动模拟一样,将流体描述为粘度为1 cP的牛顿流体,并施加一个波形作为进口边界条件,其流量与内部流动模拟的出口结果相匹配。出口设为零参考压力。
2.4.冷冻切片和免疫荧光(IF)染色
培养7天后,去除hChaMP底部(顶端)进行核糖核酸(RNA)提取(见下文)。剩余的hChaMP在4℃下用4%多聚甲醛固定过夜。第二天,hChaMPs用1X PBS洗涤三次。hChaMP腔室(在血管和切除的顶点之间)被切成两部分,以便从结构的不同区域进行切片。切片前,样品在30% w/v蔗糖的PBS中4?C孵育2 d。为了准备冷冻样品,将样品移动到30%蔗糖:O.C.T.的1:1混合物中化合物(Tissue-Tek,编号25608-930)孵育1.5小时,然后在O.C.T.化合物中低温模孵育3小时。然后将样品在-80℃下冷冻。使用徕卡CM1900低温恒温器对样品进行10µm厚度的切片。将载玻片置于室温下过夜,第二天使用或移至- 20℃。为了通过hChaMP成像细胞分布,切片用5µg ml?1 4′,6-二氨基-2-苯基吲哚(DAPI, Invitrogen, cat#D1306)染色8分钟,然后用DAPI/1,4-重氮杂环[2,2,2]辛烷(DABCO;Sigma-Aldrich, cat#D27802)在甘油和PBS。在徕卡DMi8荧光显微镜下,将载玻片成像为瓦片。为了量化ImageJ中的菌落密度,使用瓦片扫描明场图像跟踪切片的边缘,将dapi标记的瓦片扫描进行二值化,并使用Analyze Particles功能识别大于或等于1000µm2的细胞菌落。每个hChaMP分析了5个切片。通过在明场切片(菌落不容易可视化的地方)上沿着每个切片的厚度(从室外到室内)绘制10条线来定量分布,然后沿着每条线找到二值化DAPI的Plot Profile。在Microsoft Excel中分析剖面,以确定在组织厚度的每五分之一段内发生的情况。平均壁厚计算为所有线的平均长度。对于IF,用0.2% Triton X-100 (Sigma-Aldrich, cat#T8787)渗透1小时,用5%牛血清白蛋白、1%甘氨酸、2%山羊血清和0.1% Triton X-100 (BGST)的溶液阻断2小时。在BGST中,一级抗体(1µg ml-1小鼠anti-OCT3/4 [Santa CruzBiotechnology, cat#sc-5279], 5µg ml-1小鼠anti-KI67 [BD Biosciences, cat#556003],和2.5µg ml-1兔 anti-PAX6 [Invitrogen, cat#42-6600],图S2)在4℃下在切片上孵育过夜。在次级抗体(4µg ml-1 AlexaFluor 647羊 anti-mouse[Invitrogen, cat#A21236]或AlexaFluor 647羊anti-rabbit [Invitrogen, cat#A32733])中孵育2小时前,用0.2% Tween-20 (Millipore, cat#655204)在1XPBS中洗涤2次,用1XPBS洗涤1次。样品再次用Tween-20和PBS洗涤,然后用DAPI染色,并如上所述用DAPI/DABCO涂载。采集菌落20×图像,在ImageJ中定量荧光标记面积。具体来说,DAPI图像是二值化的,并且使用AnalyzeParticles特征来跟踪集落边界,作为集落小于1000µm2的感兴趣区域(roi)。然后对相应的IF图像进行二值化处理,将每个ROI内标记物覆盖的面积量化归一化为相应ROI内的DAPI密度。对于每个标记,每个hChaMP分析了>30个菌落。
2.5. RT-qPCR
用刀片轻轻去除hChaMPs的顶端,并在液氮罐中快速冷冻,以备将来提取RNA。样品裂解并使用PureLink RNA Mini Kit (Invitrogen,编号12183018A)分离RNA。使用Gen5软件在Cytation3成像阅读器(BioTek)上定量RNA的质量和数量。cDNA使用SuperScript IV VILO MasterMix (Invitrogen, cat#11756050)根据制造商的说明创建。逆转录定量聚合酶链反应(RT-qPCR)使用PowerSYBR Green Master Mix (1X,Applied Biosystems, cat#4367659)在RocheLightCycler 96(多能性标记,60°C退火)或Eppendorf Mastercycler ep realplex2(胚层标记,55°C退火)上进行30个循环。标记物的表达被标准化为GAPDH。引物序列来源于文献(Integrated DNA Technologies,表S1),并根据primer-blast[29]中所关注基因的特异性和低二聚化可能性,根据Integrated DNATechnologies 的 OligoAnalyzer Tool 选择引物对。阳性对照的hipsc衍生的胚层组织如补充信息中所述。
2.6. 统计
每种情况下测试三个hChaMPs。在JMP Pro16.0中进行样本组比较。对不相等均值(双尾)的零假设计算p值,置信区间为95%。采用学生t检验计算静态和灌注hChaMPs的p值,而RT-qPCR的多个条件采用方差分析(ANOVA)检验和事后Tukey-Kramer诚实显著性差异(HSD)检验进行比较。
3.1. 生物反应器的设计与灌注参数的选择为灌注设计的hChaMP结构如图1(a)所示(视频S1)。该结构在先前报道的结构[5]基础上进行了修改,作为单个心室,允许未来通过施加流体流动和机械阀驱动来建模心室功能(即泵送)。hChaMP是通过挤压打印的生物打印(图1(b)),由含有hiPSCs(1500万ml – 1细胞)、明胶甲基丙烯酰(GelMA)、甲基丙烯化胶原蛋白、层粘连蛋白/肠动蛋白和纤维连接蛋白的生物墨水形成。由于ecm支架的微妙性质,其存储模量为1.79±0.13 kPa(图S3),因此设计了一个生物反应器来支持hChaMP在整个灌注过程中(图1(c) – (e))。短管被用作hChaMP和生物反应器之间的连接。将管插入hChaMP中,在连接处加入无菌的20%GelMA并光交联以将管密封到位。该生物反应器包含一个隔间,用于稳定定位hChaMP,并具有两个通道,用于插入连接到hChaMP的管道。生物反应器被设计成适当地引导流体通过hChaMP的内部,然后绕过外部(图1(c)和视频S2-S3),以最大限度地实现营养交换。为了减少通过hChaMP的流体阻力,Outi比Ini大。从Outi流出的水流流入Ine, Ine进入hChaMP下方的生物反应器隔间,并从hChaMP上方的盖子流出Oute(图1(c)和视频S3)。在完成提供内部和外部流动的生物反应器设计后,考虑灌注流速。每30-60分钟灌注1分钟,这种不频繁的灌注方式导致细胞生长很少,可能是由于生物反应器和hChaMP内缺乏氧气交换以及废物去除有限。因此,采用每15分钟15 s的间歇灌注。这种流动的持续时间允许在hChaMP内部完全改变介质,并且频率支持组织内的细胞存活。
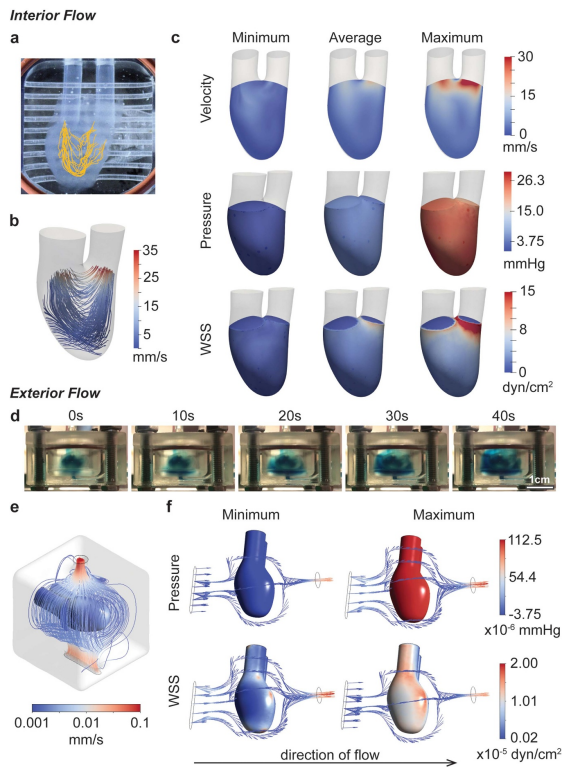
图2所示。流体流动特性。(a),(b)通过颗粒跟踪(a)和计算流体动力学(b)总结了hChaMP腔室的流动模式。(c)计算模型提供了灌注对hChaMP内壁速度、压力和壁面剪切应力的影响。(d) hChaMP外部的流动概况,用蓝色食用色素染色的DPBS进行演示。相对于流经hChaMP内部的流体,外部的流体流动速度较慢。(e) hChaMP外周流场计算模型。(f)由外部流体流动引起的压力和壁面剪应力的计算近似值(此处流动方向为从左到右)。
值得注意的是,在生物反应器中对hChaMP施加压力增加的情况下,泄漏将持续发生在管道-hChaMP界面。这种压力限制限制了该模型在下游应用中的实用性,因为当接口处存在泄漏时,hChaMP无法达到更高的压力。因此,我们探索了提高软组织对疏水管粘附性的方法。经3-(三甲氧基硅基)甲基丙烯酸丙酯预处理(补充方法,图S5(a)),油管与添加在油管- hchamp界面的GelMA的结合得到改善。这使得界面可以承受更高的压力,hChaMP本身在破裂前的最大压力达到16.8±0.6 mmHg(图S5(b), (c)和视频S4)。这是系统使用蠕动泵(~ 8.2 mmHg)时的平均压力的两倍。然而,这个最大压力或“爆裂”压力被发现低于蠕动泵施加的最大压力(~ 27.1 mmHg)。这种差异可归因于蠕动泵的振荡压力,其中低压和高压的快速波动导致hChaMP的膨胀和收缩(视频S3)。在爆炸试验中,压力被缓慢地直接施加到hChaMP壁上,导致结构不断膨胀(图S5(b)和视频S4),直到壁上变得太弱而无法容纳更多的流体。
3.2. 流体流动参数的近似值
为了近似计算流体流动对hChaMP的影响,特别是在hChaMP壁面处的压力和剪切应力,进行了计算模拟。将压力导管插入Ini或Outi底部的止血阀,测量hChaMP入口和出口的压力分布。在计算模型中,将测量到的压力剖面的最大值、最小值和平均值作为hChaMP流动的输入。SimVascular svFSI求解器是一款专门用于心血管模拟的开源软件[28],用于求解hChaMP的内部流动曲线。该软件之前已经在体外模型中进行了验证,并证明了其在描述流动动力学方面的有效性[30]。使用该软件和hChaMP的3D模型,流体流动曲线与体外实验的结果相匹配(图2(b)、S4和视频S2),证实了该模型复制系统的能力。这允许计算在hChaMP内壁上产生的剪切应力,这是干细胞培养的一个关键参数。
发现hChaMP内的压力相当均匀,在单个泵循环中的变化与实验值相匹配,平均约为4.5-5.3mmHg,最大值为25.5 mmHg(图2(c))。压力在其最小值为负,反映了在泵的脉动循环中所看到的情况。在灌注数天后,这种压力的变化似乎没有引起hChaMP完整性的问题。壁面剪切应力变化较小,平均值约为1.0 dyn cm-2,在大部分hChaMP腔室中最大值为2.7 dyn cm-2,尽管在Outi附近随着流体流出腔室急剧增加,达到15.0 dyn cm-2(图2(c))。
由于外流存在复杂的几何形状,采用AnsysFluent求解外流廓线。Fluent是开源软件SimVascular的商业替代品,已被广泛用于心血管系统的流体流动模式演示,包括体外模型[31]。求解了外流动廓形,实现了hChaMP外壁面剪应力的计算。外部的压力和壁面剪切应力要低得多,这可能是由于生物反应器的大隔间尺寸和从Outi到Ine的压力下降,导致hChaMP周围的流量较低(图2(d) – (f))。
有趣的是,外部的压力取决于所分析的位置。流体首先与hChaMP接触的下侧最大压力高于上侧;然而,两者的差别相当小,底部的最大压力为1.13 × 10-4 mmHg,上部的最大压力为1.05× 10-4 mmHg。与内部流动的压力相似,hChaMP外部的最小压力略为负,但在10 – 6 mmHg的量级上。墙体剪应力也远低于内部,范围在10-7 -10-5 dyn cm?2之间(图2(f))。总体而言,内壁剪切应力与干细胞扩增的普通生物反应器的剪切应力范围相似,而外部剪切应力远低于其值,据报道约为0.7 – 2.5 dyn cm-2[32-34]。此外,发现水凝胶中嵌入的干细胞能够承受大于30 dyn cm-2的应力[22],这表明我们设置的剪切应力近似于hiPSC扩增是合理的。
3.3. 灌注对hiPSCs生长和分布的影响为了确定流体流动对hiPSC增殖和分布的影响,在打印后1 d将hChaMPs插入生物反应器中进行灌注,使细胞有时间附着在结构上(图3(a))。随后的每一天,锥形管作为介质储存库替换为新鲜介质。油管中的介质,大约相当于系统中总体积的一半,没有被排干,以防止污染或气泡进入系统。因此,每天使用mTeSR Plus更换50%的培养基。随着组织工程中的生物制造技术变得越来越复杂,污染风险也随之增加。然而,干细胞一般避免使用抗生素,即使是短期治疗也是如此[35]。在这里,青霉素链霉素在灌注的第一天加入,并在随后的培养基更换中逐渐稀释。在这种情况下,短期暴露于青霉素-链霉素对三维培养中单一化hiPSCs的增殖和效力没有影响(图S6)。
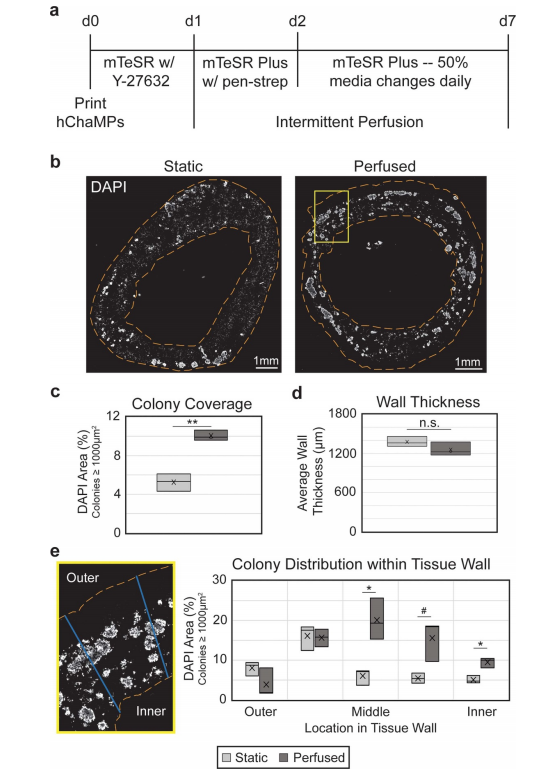
图3所示。灌注可改善hiPSC菌落的覆盖和分布。(a) hChaMP增殖时间线,打印后第1天开始间歇灌注。(b) hChaMP横 截面,用DAPI染色(白色)显示培养7 d后,灌注或不灌注时整个hChaMP的细胞密度。(c)与静态对照相比,灌注样品中 hChaMP中的菌落密度增加了一倍。(d)间歇灌注不影响壁厚。(e)在hChaMP细胞壁上划线,在ImageJ中进行处理,确定 菌落在细胞壁上的分布。灌注后的hChaMPs与静态hChaMPs相比,壁中部的菌落明显增加。在组织壁各区域进行静态和灌注hChaMPs的比较。n = 3 hChaMPs。统计上不显著;#p < 0.1,*p < 0.05,**p < 0.01)。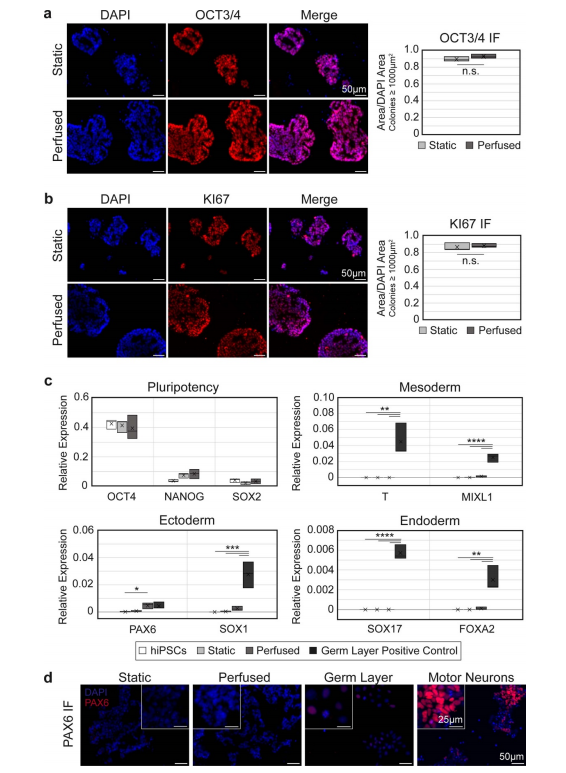
图4。hiPSCs在灌注后仍能保持多能性和增生性。(a)、(b)灌注后的hChaMPs细胞中,OCT3/4 (a)和KI67 (b)的表达仍 然很高,与静态对照细胞相当。n = 3个hChaMP,每个hChaMP >30个菌落。(c) RT-qPCR证实,与阴性(hiPSC)和阳性对照(hiPSC衍生的中胚层、内胚层或外胚层)相比,多能性标记物OCT4、NANOG和SOX2的高表达和胚层标记物的低表达相对于GAPDH的表达。(d) PAX6蛋白在静态和灌注hChaMPs中均未表达,但在胚层阳性对照中表达较低。运动神经元(分化第12天)作为参考,高水平的荧光信号对应于PAX6的高表达。不重要的;*p < 0.05,**p < 0.01,***p?0.001,****p < 0.0001)。
hChaMPs流式培养6天,打印后总培养时间为7天,然后固定并冷冻切片分析。DAPI染色(图3(b))用于确定活细胞菌落的大小和位置。在之前的工作中(图S7),我们发现不属于菌落一部分的细胞是不可存活的,因为它们可能在制造所需的单化过程中死亡,并且仍然被包裹在工程组织中。基于这些标准,我们发现灌注结构的hiPSC菌落密度相对于静态培养基中的对照组增加了1.9倍(图3(c))。对切片组织进行检查,以验证流动对hChaMP完整性没有影响。静态和灌注的hChaMPs保持一致的壁厚,约为1.2-1.4 mm(图3(d))。
此外,与静态培养的hChaMPs相比,灌注hChaMPs改善了hiPSC菌落在细胞壁内的分布(图3(e))。灌注的hChaMPs中,大多数hipsc位于组织壁的中部,在组织壁的不同区域间菌落数量变化较小。另一方面,静态对照的菌落位于hChaMP外侧附近,在整个组织中的分布较少。有趣的是,灌注和静态hChaMP在hChaMP最外层的菌落百分比相对于下一个内部部分都要低。这可能是由于在支撑槽移除和介质改变或灌注过程中细胞丢失所致。3.4. 灌注对hiPSC多能性的影响为了测试来自流体流动的剪切应力是否会导致hiPSCs的不良分化,对hChaMPs的冷冻切片进行OCT3/4 IF染色(图4(a))。集落的定性和定量分析表明,几乎所有细胞都保持多能性,多能性与静态对照相当。此外,细胞高度增殖,KI67在整个菌落中呈阳性表达(图4(b))。这表明hipsc在间歇灌注后仍保持其多能性和自我更新特性。接下来,使用RT-qPCR来量化多能性标记,以及来自每个胚层的标记,以在转录物水平上确认我们的结果(图4(c))。与2D培养的hiPSC对照相比,在静态和灌注状态下,OCT4、NANOG和SOX2的表达均保持较高水平。总的来说,除了一个例外,没有检测到胚层标记物,或者发现相对
于hiPSCs或静态hChaMPs的水平不显著。外胚层标志物PAX6在灌注hChaMP细胞中的表达高于2DhiPSCs (p=0.044)。然而,IF染色显示PAX6在hChaMPs中没有蛋白水平的表达(图4(d))。
生物反应器的开发是一个反复的过程,成功增殖的最重要参数是对软水凝胶的精细处理和连接处的防泄漏,以确保通过hChaMP内部进行灌注。早期尝试以垂直、直立的姿势灌注hChaMP,成功地提高了细胞在内部的活力。然而,难以设置hChaMP进行灌注,并且需要一个小的隔间尺寸来保持hChaMP,最大限度地减少了hChaMP周围的营养物质体积,使得这些生物反应器设计不切实际。因此,目前的生物反应器设计将hChaMP放置在仰卧位置,为养分交换提供了简单的设置和足够的培养基体积。精细的操作仍然是灌注成功的关键。在hChaMP打印分辨率较差的情况下,管子插入变得更加困难,需要更严格的处理,导致培养第7天菌落形成急剧减少。此外,压差在确保通过hChaMP内部灌注方面发挥了重要作用。设计初期的一个常见问题是hChaMP油管连接处的泄漏,尽管添加了GelMA来形成密封。我们发现,在灌注前,必须在Outi处连接充满DPBS的油管,以消除表面张力,这种张力会产生压差,阻碍hChaMP内部的灌注,导致连接处泄漏。再加上Outi相对于进油管尺寸的增加,从本质上解决了这个问题,促进了流体通过hChaMP内部的流动。翻译生物打印方法的一个很大的限制是需要大量的细胞达到生理密度,当工程组织的大小增加到生理尺度时,这一点尤为重要。允许细胞在原位增殖减少了对大量孔板和相应的单层扩增介质体积的需求。在这里,只需要一个6孔板(1000万个hiPSCs)就可以产生厘米级的hChaMP。进一步优化培养时间、打印时的细胞密度,或调整ROCK抑制剂和/或类似的生化化合物处理,可以进一步增加分化前的hiPSC密度。增加培养时间可能会允许进一步的细胞生长,但不适合扩大规模和组织应用。这也可能进一步影响基因表达。在培养的第7天,多能性和胚层标记物在RNA水平上几乎没有变化,但灌注的hChaMPs中外胚层标记物PAX6略有增加。在蛋白水平上,PAX6未在hChaMPs中表达。这一结果与暴露于0.003 – 5 dyn cm – 2剪切应力下的小鼠PSCs的研究一致,其中神经标记物的表达与静态培养相当[41,42]。与2D培养的hiPSCs相比,灌注的hChaMPs中NANOG RNA表达也有轻微但不显著的增加。有趣的是,最近的一项研究发现,在暴露于流动的小鼠iPSCs中,NANOG和OCT4的表达也有类似的增加,这可能是由于涉及E-cadherin和/或β-catenin的机械转导[43]。此外,在人类多能干细胞中,NANOG被认为可以抑制外胚层的形成[44],并通过调节进入细胞周期的s期来增加细胞增殖[45],这表明NANOG可能在灌注的hChaMPs中发挥有益作用。因此,需要进一步的研究来确定长时间灌注对hiPSCs的影响。生物墨水中的细胞密度可能会进一步优化以增加菌落数量,但正如所讨论的那样,这受到用于打印的喷嘴尺寸的限制。另外,用10µM ROCK抑制剂Y-27632或法舒地尔治疗多日可提高干细胞增殖率,s期细胞比例增加[46]。同样,类黄酮3,2 ‘ -二羟黄酮(3,2 ‘ DHF)已被证明可以增加hiPSCs的增殖、s期细胞的百分比和细胞内谷胱甘肽的表达[47],这可能在细胞增殖的表观遗传调控中发挥作用[48]。与单独使用任何一种分子相比,3,2 ‘ -DHF和Y-27632联合处理hiPSCs进一步改善了增殖[47],这表明有希望的方法可以与灌注结合进一步改善细胞密度和组织厚度。在hChaMP中获得所需的hiPSC密度后,下一步将是分化。先前的研究表明,在剪切作用下,有可能分化为中胚层[49-52]、内胚层[53,54]和外胚层[51,55]。此外,考虑到剪切应力在胎儿发育中的作用[56-59],仿生血流可能有利于分化组织的功能。然而,在某些分化情况下,高水平的剪切应力是有害的。例如,Ting等人发现,在心肌细胞分化过程中,在摇椅上持续搅拌导致心肌细胞非常少;然而,与静态培养相比,间歇性搅拌可使分化效率提高约38%[49]。同样,在微载体的肝脏分化中,在分化的早期阶段,超过30 rpm的搅拌会导致细胞脱离微载体[54]。因此,生物反应器中的分化参数需要针对所需的组织类型进行优化,以平衡营养输送/废物清除和维持细胞健康。作为诱导多系分化进展的方法,原位hiPSC增殖的效用可以进一步增强[60-65]。这种方法,从不同的支架材料特性到改变细胞因子或培养基成分以及基因工程hiPSCs,可以很容易地转化为生物打印和生物反应器设置,以获得大量不同类型的细胞。分化为多种组织类型,可以研究发育过程中相关组织的形成,疾病进展中不同组织之间的串扰,或各种治疗方法和剂量对各种器官的潜在影响。例如,起搏器和心室心肌细胞的空间分化将极大地增强药物筛选研究,提供对给定治疗的心律和泵功能的见解。纤维母细胞、免疫细胞或神经细胞的掺入也可以进一步增强仿生功能。
同样,许多组织工程研究现在都集中在结合血管的方法上,以增加营养供应和可能的组织厚度。然而,在我们的实验中纳入内皮细胞和其他相关细胞类型可能会导致不必要的旁分泌信号,从而影响打印组织中干细胞的多能性或分化效率[66]。在分化为所需的细胞类型后,内皮细胞可以被纳入像我们这样的模型中,其中灌注可以进一步实现对内皮重要的机械转导[67,68],并可能诱导血管生成[69]。血管的存在将允许营养输送的增加,从而进一步开发工程组织的效用。
生物3D打印领域的最新发展极大地扩展了创造复杂的、与生理相关的体外组织的潜力。当这些组织由人类来源的细胞形成时,所产生的模型可以提供对疾病机制、进展和治疗的增强研究,作为动物模型的补充。在这里,我们利用介质灌注和3d生物打印室结构中hipsc的高增殖能力,实现了生成厚组织模型的目标。总的来说,我们预计,随着该领域在创造更复杂组织方面的发展,特别是与正在开发的工程策略相结合,这种在这种模型中扩展hipsc的能力将是重要的。在该模型中看到的连续的hipsc集落的形成将允许各种组织类型的原位分化,以便生成具有更高功能和一致性的组织,从而可靠地进行体外建模。
数据可用性声明支持本研究结果的所有数据都包含在文章中(以及任何补充文件)。
致谢我们感谢Jeffrey Ai帮助重新设计用于灌注的hChaMP结构,Aimee Renaud生成外胚层阳性对照,Victor Garcia获得hChaMP、生物反应器和装置的图像,以及明尼苏达大学实验外科服务部门帮助测量破裂压力。我们感谢我们的资金来源,美国国立卫生研究院T32GM008347 (ERK),R01HL137204 (ERK, WL和BMO)和NIBIB/NIH工程复杂组织中心P41 EB023833,以及美国心脏协会905669 (ERK)。
参考文献
[1]Gudapati H, Dey M and Ozbolat I 2016 A comprehensivereview on droplet-based bioprinting: past, present andfuture Biomaterials 102 20–42
[2] Skylar-Scott M A, Uzel S G M, Nam L L, Ahrens J H,Truby R L, Damaraju S and Lewis J A 2019Biomanufacturing of organ-specific tissues with high cellulardensity and embedded vascular channels Sci. Adv. 5 9
[3]Murata D, Arai K and Nakayama K 2020 Scaffold-freebio-3D printing using spheroids as ‘bio-inks’ for tissue(re-)construction and drug response tests Adv. HealthcareMater. 9 1901831
[4] Daly A C, Davidson M D and Burdick J A 2021 3Dbioprinting of high cell-density heterogeneous tissue modelsthrough spheroid fusion within self-healing Nat. Commun.12 1–13
[5] Kupfer M E et al 2020 In situ expansion, differentiation andelectromechanical coupling of human cardiac muscle in a 3Dbioprinted, chambered organoid Circ. Res. 127 207–24
[6] Ouyang L, Yao R, Mao S, Chen X, Na J and Sun W 2015Three-dimensional bioprinting of embryonic stem cellsdirects highly uniform embryoid body formationBiofabrication 7 4
[7] Faulkner-Jones A, Fyfe C, Cornelissen D-J, Gardner J, King J,Courtney A and Shu W 2015 Bioprinting of humanpluripotent stem cells and their directed differentiation intohepatocyte-like cells for the generation of mini-livers in 3DBiofabrication 7 4
[8] Ouyang L, Yao R, Zhao Y and Sun W 2016 Effect of bioinkproperties on printability and cell viability for 3Dbioplotting of embryonic stem cells Biofabrication 8 3
[9] Gu Q, Tomaskovic-Crook E, Wallace G G and Crook J M2017 3D bioprinting human induced pluripotent stem cellconstructs for in situ cell proliferation and successivemultilineage differentiation Adv. Healthcare Mater. 6 17
[10] Li Y, Jiang X, Li L, Chen Z-N, Gao G, Yao R and Sun W 20183D printing human induced pluripotent stem cells withnovel hydroxypropyl chitin bioink: scalable expansion anduniform aggregation Biofabrication 10 4
[11] Hamid O A, Eltaher H M, Sottile V and Yang J 2021 3Dbioprinting of a stem cell-laden, multi-material tubularcomposite: an approach for spinal cord repair Mater. Sci.Eng. C 120 111707
[12] Kerscher P, Turnbull I C, Hodge A J, Kim J, Seliktar D,Easley C J, Costa K D and Lipke E A 2016 Direct hydrogelencapsulation of pluripotent stem cells enables ontomimeticdifferentiation and growth of engineered human hearttissues Biomaterials 83 383–95
[13] Gilmozzi V et al 2021 Generation of hiPSC-derivedfunctional dopaminergic neurons in alginate-based 3Dculture Front. Cell Dev. Biol. 9 708389
[14] Gao L et al 2017 Myocardial tissue engineering with cellsderived from human-induced pluripotent stem cells and anative-like, high-resolution, 3-dimensionally printedscaffold Circ. Res. 120 1318–25
[15] Radisic M, Malda J, Epping E, Geng W, Langer R andVunjak-Novakovic G 2006 Oxygen gradients correlate withcell density and cell viability in engineered cardiac tissueBiotechnol. Bioeng. 93 332–43
[16] Ahmed S, Chauhan V M, Ghaemmaghami A M andAylott J W 2018 New generation of bioreactors that advanceextracellular matrix modelling and tissue engineeringBiotechnol. Lett. 41 1–25
[17] Zhang J, Wehrle E, Rubert M and Müller R 2021 3Dbioprinting of human tissues: biofabrication, bioinks, andbioreactors Int. J. Mol. Sci. 22 3971
[18] Adamo L et al 2009 Biomechanical forces promoteembryonic haematopoiesis Nature 459 1131–5
[19] Yamamoto K, Sokabe T, Watabe T, Miyazono K,Yamashita J K, Obi S, Ohura N, Matsushita A, Kamiya A andAndo J 2005 Fluid shear stress induces differentiation ofFlk-1-positive embryonic stem cells into vascular endothelialcells in vitro Am. J. Physiol. Circ. Physiol. 288 H1915–24
[20] Ahsan T and Nerem R M 2010 Fluid shear stress promotesan endothelial-like phenotype during the earlydifferentiation of embryonic stem cells Tissue Eng. A 16 3547
[21] Greuel S, Freyer N, Hanci G, Böhme M, Miki T, Werner J,Schubert F, Sittinger M, Zeilinger K and Mandenius C-F2019 Online measurement of oxygen enables continuousnoninvasive evaluation of human-induced pluripotent stemcell (hiPSC) culture in a perfused 3D hollow-fiber bioreactorJ. Tissue Eng. Regen. Med. 13 1203–16
[22] Fattahi P et al 2021 Core–shell hydrogel microcapsulesenable formation of human pluripotent stem cell spheroidsand their cultivation in a stirred bioreactor Sci. Rep.11 1–13
[23] Isidro I A et al 2021 Online monitoring of hiPSC expansionand hepatic differentiation in 3D culture by dielectricspectroscopy Biotechnol. Bioeng. 118 3610–7
[24] Borys B S et al 2021 Overcoming bioprocess bottlenecks inthe large-scale expansion of high-quality hiPSC aggregates invertical-wheel stirred suspension bioreactors Stem Cell Res.Ther. 12 1–19
[25] Nogueira D E S, Rodrigues C A V, Carvalho M S,Miranda C C, Hashimura Y, Jung S, Lee B and Cabral J M S2019 Strategies for the expansion of human inducedpluripotent stem cells as aggregates in single-useVertical-WheelTM bioreactors J. Biol. Eng. 13 74
[26] Zhu W, Zhao M, Mattapally S, Chen S and Zhang J 2018CCND2 overexpression enhances the regenerative potency ofhuman induced pluripotent stem cell-derivedcardiomyocytes: remuscularization of injured ventricle Circ.Res. 122 88–96
[27] Lee A, Hudson A R, Shiwarski D J, Tashman J W, Hinton T J,Yerneni S, Bliley J M, Campbell P G and Feinberg A W 20193D bioprinting of collagen to rebuild components of thehuman heart Science 365 482–7
[28] Figueroa C A, Vignon-Clementel I E, Jansen K E,Hughes T J R and Taylor C A 2006 A coupled momentummethod for modeling blood flow in three-dimensionaldeformable arteries Comput. Methods Appl. Mech. Eng.195 5685–706
[29] Ye J, Coulouris G, Zaretskaya I, Cutcutache I, Rozen S andMadden T L 2012 Primer-BLAST: a tool to designtarget-specific primers for polymerase chain reaction BMCBioinform. 13 134
[30] Kung E O, Les A S, Figueroa C A, Medina F, Arcaute K,Wicker R B, McConnell M V and Taylor C A 2011 In vitrovalidation of finite element analysis of blood flow indeformable models Ann. Biomed. Eng. 39 1947–60
[31] Bonfanti M, Franzetti G, Homer-Vanniasinkam S,Díaz-Zuccarini V and Balabani S 2020 A combined in vivo, invitro, in silico approach for patient-specific haemodynamicstudies of aortic dissection Ann. Biomed. Eng. 48 2950–64
[32] Sargent C Y, Berguig G Y, Kinney M A, Hiatt L A,Carpenedo R L, Berson R E and McDevitt T C 2010Hydrodynamic modulation of embryonic stem celldifferentiation by rotary orbital suspension cultureBiotechnol. Bioeng. 105 611–26
[33] Wang Y, Chou B K, Dowey S, He C, Gerecht S and Cheng L2013 Scalable expansion of human induced pluripotentstem cells in the defined xeno-free E8 medium underadherent and suspension culture conditions Stem Cell Res.11 1103–16
[34] Ismadi M Z, Gupta P, Fouras A, Verma P, Jadhav S, Bellare Jand Hourigan K 2014 Flow characterization of a spinnerflask for induced pluripotent stem cell culture applicationPLoS One 9 e106493
[35] Farzaneh M 2021 Concise review; effects of antibiotics andantimycotics on the biological properties of humanpluripotent and multipotent stem cells Curr. Stem Cell Res.Ther. 16 400–5
[36] Carrier R L, Rupnick M, Langer R, Schoen F J, Freed L E andVunjak-Novakovic G 2002 Perfusion improves tissuearchitecture of engineered cardiac muscle Tissue Eng.8 175–88
[37] Radisic M, Yang L, Boublik J, Cohen R J, Langer R, Freed L Eand Vunjak-Novakovic G 2004 Medium perfusion enablesengineering of compact and contractile cardiac tissue Am. J.Physiol.—Heart Circ. Physiol. 286 507–16
[38] Dahlin R L, Meretoja V V, Ni M, Kasper F K and Mikos A G2012 Design of a high-throughput flow perfusion bioreactorsystem for tissue engineering Tissue Eng. C 18 817–20
[39] Gabetti S et al 2022 An automated 3D-printed perfusionbioreactor combinable with pulsed electromagnetic fieldstimulators for bone tissue investigations Sci. Rep. 12 13859
[40] Yamada S, Yassin M A, Schwarz T, Mustafa K andHansmann J 2022 Optimization and validation of acustom-designed perfusion bioreactor for bone tissueengineering: flow assessment and optimal cultureenvironmental conditions Front. Bioeng. Biotechnol.10 811942
[41] Nsiah B A, Ahsan T, Griffiths S, Cooke M, Nerem R M andMcDevitt T C 2014 Fluid shear stress pre-conditioningpromotes endothelial morphogenesis of embryonic stemcells within embryoid bodies Tissue Eng. A 20 954–65
[42] Blagovic K, Kim L Y and Voldman J 2011 Microfluidicperfusion for regulating diffusible signaling in stem cellsPLoS One 6 8
[43] Nath S C, Day B, Harper L, Yee J, Hsu C Y-M, Larijani L,Rohani L, Duan N, Kallos M S and Rancourt D E 2021 Fluidshear stress promotes embryonic stem cell pluripotency viainterplay between β-catenin and vinculin in bioreactorculture Stem Cells 39 1166–77
[44] Wang Z, Oron E, Nelson B, Razis S and Ivanova N 2012Distinct lineage specification roles for NANOG, OCT4, andSOX2 in human embryonic stem cells Cell Stem Cell10 440–54
[45] Zhang X et al 2009 A role for NANOG in G1 to S transitionin human embryonic stem cells through direct binding ofCDK6 and CDC25A J. Cell Biol. 184 67
[46] Watanabe K et al 2007 A ROCK inhibitor permits survival ofdissociated human embryonic stem cells Nat. Biotechnol.25 681–6
[47] Kim K et al 2020 3,2′ -Dihydroxyflavone improves theproliferation and survival of human pluripotent stem cellsand their differentiation into hematopoietic progenitor cellsJ. Clin. Med. 9 3
[48] Pallardó F V, Markovic J, García J L and Vi˜na J 2009 Role ofnuclear glutathione as a key regulator of cell proliferationMol. Aspects Med. 30 77–85
[49] Ting S, Chen A, Reuveny S and Oh S 2014 An intermittentrocking platform for integrated expansion anddifferentiation of human pluripotent stem cells tocardiomyocytes in suspended microcarrier cultures Stem CellRes. 13 202–13
[50] Correia C et al 2014 Combining hypoxia and bioreactorhydrodynamics boosts induced pluripotent stem celldifferentiation towards cardiomyocytes Stem Cell Rev. Rep.10 786–801
[51] Badenes S M, Fernandes T G, Cordeiro C S M, Boucher S,Kuninger D, Vemuri M C, Diogo M M and Cabral J M S2016 Defined essential 8TM medium and vitronectinefficiently support scalable xeno-free expansion of humaninduced pluripotent stem cells in stirred microcarrier culturesystems PLoS One 11 e0151264
[52] Ackermann M et al 2018 Bioreactor-based mass productionof human iPSC-derived macrophages enablesimmunotherapies against bacterial airway infections Nat.Commun. 9 1–13
[53] Lock L T and Tzanakakis E S 2009 Expansion anddifferentiation of human embryonic stem cells to endodermprogeny in a microcarrier stirred-suspension culture TissueEng. A 15 2051–63
[54] Park Y, Chen Y, Ordovas L and Verfaillie C M 2014 Hepaticdifferentiation of human embryonic stem cells onmicrocarriers J. Biotechnol. 174 39–48
[55] Qiu L, Lim Y M, Chen A K, Reuveny S, Oh S K W, Tan E Kand Zeng L 2016 Microcarrier-expanded neural progenitorcells can survive, differentiate, and innervate host neuronsbetter when transplanted as aggregates Cell Transplant.25 1343–57
[56] Hove J R, Köster R W, Forouhar A S, Acevedo-Bolton G,Fraser S E and Gharib M 2003 Intracardiac fluid forces arean essential epigenetic factor for embryonic cardiogenesisNature 421 172–7
[57] Courchaine K, Rykiel G and Rugonyi S 2018 Influence ofblood flow on cardiac development Prog. Biophys. Mol. Biol.137 95
[58] Conrad L et al 2021 The biomechanical basis of biasedepithelial tube elongation in lung and kidney developmentDevelopment 148 9
[59] Lorenz L et al 2018 Mechanosensing by β1 integrin inducesangiocrine signals for liver growth and survival Nature562 128–32
[60] Ng W H et al 2022 Recapitulating human cardio-pulmonaryco-development using simultaneous multilineagedifferentiation of pluripotent stem cells eLife 11 e67872
[61] Skylar-Scott M A, Huang J Y, Lu A, Ng A H M, Duenki T,Liu S, Nam L L, Damaraju S, Church G M and Lewis J A2022 Orthogonally induced differentiation of stem cells forthe programmatic patterning of vascularized organoids andbioprinted tissues Nat. Biomed. Eng. 6 449–62
[62] Giacomelli E, Bellin M, Sala L, van Meer B J, Tertoolen L G J,Orlova V V and Mummery C L 2017 Three-dimensionalcardiac microtissues composed of cardiomyocytes andendothelial cells co-differentiated from human pluripotentstem cells Development 144 1008–17
[63] Wu F, Wu D, Ren Y, Huang Y, Feng B, Zhao N, Zhang T,Chen X, Chen S and Xu A 2019 Generation of hepatobiliaryorganoids from human induced pluripotent stem cells J.Hepatol. 70 1145–58
[64] Jin G, Floy M E, Simmons A D, Arthur M M and Palecek S P2021 Spatial stem cell fate engineering via facile morphogenlocalization Adv. Healthcare Mater. 10 2100995
[65] Kilian D, Cometta S, Bernhardt A, Taymour R, Golde J,Ahlfeld T, Emmermacher J, Gelinsky M and Lode A 2022Core-shell bioprinting as a strategy to apply differentiationfactors in a spatially defined manner inside osteochondraltissue substitutes Biofabrication 14 1
[66] Freyer N, Greuel S, Knöspel F, Strahl N, Amini L, Jacobs F,Monshouwer M and Zeilinger K 2017 Effects of co-culturemedia on hepatic differentiation of hiPSC with or withoutHUVEC co-culture Int. J. Mol. Sci. 18 1724
[67] Davies P F 2009 Hemodynamic shear stress and theendothelium in cardiovascular pathophysiology Nat. Clin.Pract. Cardiovasc. Med. 6 16–26
[68] Kinstlinger I S, Calderon G A, Royse M K, Means A K,Grigoryan B and Miller J S 2021 Perfusion andendothelialization of engineered tissues with patternedvascular networks Nat. Protocols 16 3089–113
[69] Galie P A, Nguyen D H T, Choi C K, Cohen D M, Janmey P Aand Chen C S 2014 Fluid shear stress threshold regulatesangiogenic sprouting Proc. Natl Acad. Sci. USA 111 7968–73

